پیوند شیمیایی
شیمی برای بچه ها – پیوند شیمیایی
پیوند شیمیایی – دنیای اطراف ما از واحدهای کوچکی از ماده به نام اتم تشکیل شده است .
نحوه چسبیدن این اتم ها به یکدیگر برای تشکیل مواد پیوند شیمیایی نامیده می شود.
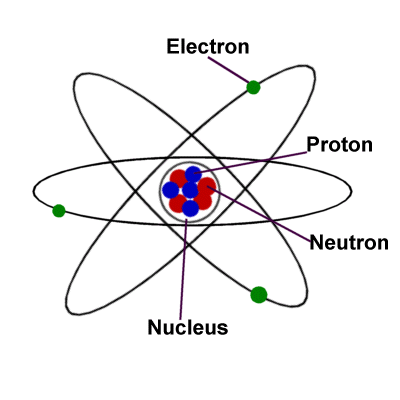
درباره اتم ها
هر عنصر اتم منحصر به فرد خود را دارد که از تعداد خاصی پروتون در هسته خود به نام عدد اتمی تشکیل شده است.
هر اتم همچنین دارای همان تعداد الکترون است که پروتون دارد.
پوسته های الکترونی
الکترون ها به دور هسته اتم می چرخند. آنها در لایه هایی به نام پوسته باقی می مانند.
هر پوسته فقط می تواند حاوی تعداد معینی الکترون باشد: لایه اول می تواند دو الکترون، لایه دوم هشت الکترون، لایه سوم هجده الکترون و غیره را در خود جای دهد.
پوسته بیرونی
همه اتم ها دوست دارند یک پوسته بیرونی کامل داشته باشند، اما تنها عناصری که به طور طبیعی پوسته بیرونی کامل دارند، گازهای نجیب سمت راست جدول تناوبی هستند.
در نتیجه، هنگامی که اتمهای بدون لایه بیرونی کامل با اتمهای دیگر تماس پیدا میکنند، تمایل دارند که از دست بدهند یا الکترون به دست آورند.
الکترونهای ظرفیتی
الکترونهای ظرفیتی تعداد الکترونهایی هستند که در لایه بیرونی یک اتم میتوانند در تشکیل پیوندهای شیمیایی با اتمهای دیگر شرکت کنند.
اتم هایی با پوسته بیرونی نسبتا خالی می خواهند الکترون ها را رها کنند.
برای مثال، اگر یک اتم 1 الکترون از 8 الکترون ممکن را در لایه بیرونی خود داشته باشد، میخواهد آن الکترون را رها کند، بنابراین لایه بیرونی آن اکنون پر است.
اتمهایی که پوسته بیرونی نسبتاً پر دارند، میخواهند الکترونهایی به دست آورند تا لایه بیرونی را پر کنند.
به عنوان مثال، اتمی با 6 الکترون از 8 الکترون در لایه بیرونی خود سعی می کند 2 الکترون به دست آورد تا لایه بیرونی آن پر شود.
پیوند یونی
یونی زمانی اتفاق میافتد که یک عنصر یک الکترون (یا الکترون) به دیگری اهدا کند تا هر دو عنصر یک پوسته بیرونی کامل داشته باشند.
مثال:
در اینجا مثالی است که نشان می دهد لیتیوم (که دارای 3 الکترون و 1 در لایه بیرونی است) و فلوئور (که دارای 9 الکترون و 7 الکترون در پوسته بیرونی است) یک الکترون را برای تشکیل LiF یا لیتیوم فلوراید اهدا می کنند.
به این پیوند یونی می گویند.
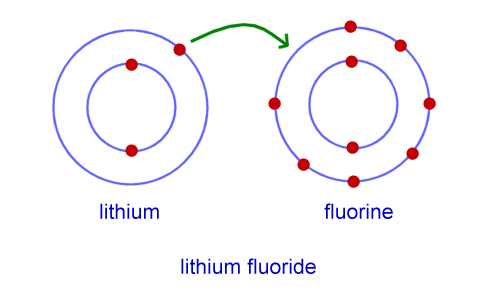
نمونه ای از پیوند یونی
پیوند کووالانسی
در پیوند کووالانسی، الکترونها بین اتمها به اشتراک گذاشته میشوند تا اهدا شوند تا اتمهای هر دو عنصر پوسته بیرونی کامل به دست آورند.
الکترون ها همیشه به صورت جفت به اشتراک گذاشته می شوند.
مثال:
نمونه ای از پیوند کووالانسی، مولکول دی اکسید کربن است.
در این مثال کربن دارای 4 الکترون از 8 الکترون در لایه بیرونی خود و اکسیژن دارای 6 الکترون از هشت الکترون است.
با ترکیب دو اتم اکسیژن با یک اتم کربن، اتم ها می توانند الکترون ها را به اشتراک بگذارند به طوری که هر اتم دارای یک پوسته بیرونی کامل باشد.
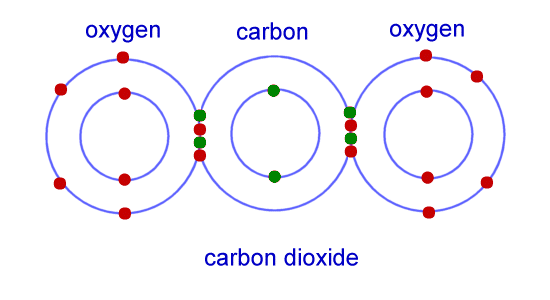
نمونه ای از پیوند کووالانسی
حقایق جالب در مورد پیوندهای شیمیایی
- از آنجایی که گازهای نجیب به طور طبیعی پوسته بیرونی کاملی دارند، به ندرت واکنش نشان می دهند.
- در پیوندهای فلزی تعداد زیادی اتم الکترون های خود را از دست می دهند.
- پیوند یونی بیشتر بین فلزات واقع در سمت چپ جدول تناوبی ایجاد می شود.
- اتم های موجود در مولکول ها با جاذبه بین هسته و الکترون های مشترک کنار هم نگه داشته می شوند.

